Inleiding
De incidentie van het oesofaguscarcinoom in Nederland is de laatste jaren fors toegenomen: van 684 diagnoses in 1989 naar ruim 2.500 diagnoses in 2019. Deze stijging betreft vooral adenocarcinomen van de oesofagus. Het aantal plaveiselcelcarcinomen is stabiel gebleven en betreft thans minder dan 30 procent van het totaal aantal oesofaguscarcinomen. Wereldwijd is ongeveer 90 procent van het totaal aantal oesofaguscarcinomen een plaveiselcelcarcinoom.
De huidige standaardbehandeling voor een oesofaguscarcinoom of carcinoom van de gastro-oesofageale overgang zonder aantoonbare metastasen is neoadjuvante chemoradiatie gevolgd door een in opzet curatieve resectie. In Nederland bestaat de chemoradiatie uit een combinatie van carboplatine en paclitaxel en 23 fracties radiotherapie zoals onderzocht in de Nederlandse CROSS-trial.1 In de Verenigde Staten en elders in Europa wordt ook wel neoadjuvante chemoradiatie met 5-FU en cisplatine of 5-FU en oxaliplatine gegeven.2
In de hier te bespreken CheckMate 577-studie3 werden patiënten met een in opzet curatief te behandelen oesofaguscarcinoom of een carcinoom van de gastrooesofageale overgang bij wie na neoadjuvante chemoradiatie sprake was van een radicale resectie en aantoonbare residuele tumor (in de primaire tumor of in regionale lymfeklieren) 2:1 gerandomiseerd tussen nivolumab of placebo tot recidiefziekte of tot maximaal 1 jaar behandelduur.
Nivolumab is als monotherapie door de EMA geregistreerd voor de adjuvante behandeling van volwassen patiënten met een carcinoom van de oesofagus of een carcinoom van de gastro-oesofageale overgang die na eerdere neoadjuvante behandeling met chemoradiatie nog pathologische restziekte hebben.
1. Kankersoort en lijn van behandeling
Adjuvante behandeling met nivolumab werd onderzocht bij patiënten met een oesofaguscarcinoom of een carcinoom van de gastro-oesofageale overgang bij wie na neoadjuvante chemoradiatie sprake was van een radicale resectie en aantoonbare residuele tumor (in de primaire tumor of in de regionale lymfeklieren).
2. Vergelijking met de referentiebehandeling in Nederland
In de CheckMate 577-studie wordt adjuvante behandeling met nivolumab vergeleken met placebo. In Nederland wordt aan patiënten met oesofaguscarcinoom na neoadjuvante chemoradiatie en slokdarmresectie geen systemische adjuvante behandeling gegeven.
3. Methode en kwaliteit van de studie
CheckMate 577 is een dubbelblind gerandomiseerde fase III-multicenterstudie voor patiënten met een oesofaguscarcinoom of een carcinoom van de gastro-oesofageale overgang bij wie na neoadjuvante chemoradiatie sprake was van een radicale resectie en aantoonbare residuele tumor (in de primaire tumor of in de regionale lymfeklieren). Om voor inclusie in aanmerking te komen dienden patiënten 18 jaar of ouder te zijn en een ECOG-performancestatus van 0 of 1 te hebben. Alle patiënten dienden een stadium II of III (conform 7th edition AJCC), histologisch bewezen adeno- of plaveiselcelcarcinoom van de oesofagus of gastro-oesofageale overgang te hebben. Alle patiënten ondergingen neoadjuvante chemoradiatie gevolgd door slokdarmresectie.
Er wordt niet gedefinieerd wat de tijd mocht zijn van pathologische diagnose tot start van eerste chemoradiatie of de tijd tussen chemoradiatie en slokdarmresectie. Het soort chemotherapie dat onderdeel van de chemoradiatie was, werd niet vooraf gespecificeerd. De resectie diende radicaal te zijn (R0; geen vitaal tumorweefsel binnen 1 mm van het resectievlak proximaal, distaal of circumferentieel). Er diende in het resectiepreparaat vitaal tumorweefsel aanwezig te zijn: residuale pathologische ziekte met minimaal ypT1 en/of ypN1. Patiënten met een indicatie voor corticosteroïden (>10 mg per dag) of andere immunosuppressiva werden geëxcludeerd.
Binnen 4 tot 16 weken na de slokdarmresectie werden patiënten 2:1 gerandomiseerd tussen behandeling met nivolumab (240 mg eenmaal per 2 weken gedurende 16 weken gevolgd door 480 mg eenmaal per 4 weken vanaf week 17) tot recidiefziekte of tot maximaal 1 jaar, en identiek placebo volgens hetzelfde schema. Dosisaanpassing was niet toegestaan. Een behandelonderbreking van maximaal 6 weken was toegestaan gedurende de eerste 16 weken, en maximaal 10 weken gedurende de rest van de behandelperiode. De behandeling met nivolumab kon ook vroegtijdig worden afgebroken op verzoek van de patiënt, bij klinische verslechtering van de conditie van de patiënt, bij recidiefziekte of om veiligheidsredenen (bijwerkingen). De behandeling werd gestratificeerd naar PD-L1-expressie (≥ 1 procent, < 1 procent, niet te bepalen of niet beschikbaar), pathologische lymfeklierstatus (≥ ypN1 of ypN0) en histologie (plaveiselcelcarcinoom of adenocarcinoom).
Bij de opzet van de studie waren ziektevrije overleving (DFS) en totale overleving (OS) de coprimaire eindpunten van de studie. Tijdens de inclusieperiode werd het primaire eindpunt aangepast naar DFS vanwege een lastige voortgang van de inclusie, met als reden dat DFS een goed surrogaat zou zijn van OS bij oesofaguscarcinoom.4 DFS werd gedefinieerd als de tijd van randomisatie tot het moment van vastleggen van recidiefziekte (lokaal, regionaal of op afstand, middels beeldvorming of middels weefseldiagnose) of overlijden. Secundaire eindpunten in het aangepaste protocol waren OS en totale overleving na 1, 2 en 3 jaar. Exploratieve eindpunten waren veiligheid, metastasevrije overleving en patient reported outcome measures (PROM’s) middels de functional assessment of cancer therapy-esophageal (FACT-E) en de 3-level European quality of life-5 dimensions questionnaire (EQ-5D-3L). Een CT- of MRI-scan voor evaluatie van ziekteactiviteit werd in de eerste 2 jaar elke 12 weken gemaakt, en in jaar 3 tot 5 minimaal elke 6 tot 12 maanden afhankelijk van lokale afspraken. Bij duidelijk recidief van ziekte was beeldvorming voldoende en bij twijfel volgde er een cytologisch of histologisch biopt ter bevestiging of werd de beeldvorming na 4 weken herhaald. Lymfekliermetastasen werden als bevestigd beschouwd bij het ontstaan van een lymfekliervergroting van minimaal 1 cm in de korte as. PD-L1-expressie op de tumorcellen werd in twee centrale laboratoria verricht (PD-L1 IHC 28-8 pharmDx van DAKO). Ook werd een combined positivity score (CPS) bepaald.
In het eerste jaar werden bij elk follow-upbezoek ook PROM’s vastgelegd en nadien iedere 3 maanden tot 2 jaar na de laatste behandeling. Bijwerkingen van de behandeling werden geëvalueerd volgens CTC-AE v4.0. Informatie over vervolgbehandelingen is verzameld in deze studie.
Volgens het aangepaste ontwerp van de studie (protocol v4.0) waren er ongeveer 760 patiënten en ten minste 440 DFS-events nodig om met 91 procent power en een tweezijdige alfa van 5 procent een hazard ratio (HR) van 0,72 voor recidief vast te kunnen stellen. In een interimanalyse werd voorzien. Bij de eerste interim-analyse werd uitgegaan van 85 procent van de DFS-events waarbij de P-waarde lager dan 0,036 diende te zijn. Tijdens een bijeenkomst van de independent data monitoring committee (IDMC) in mei 2020 (na inclusie van 794 patiënten) werd de eerste interim-analyse verricht. Analyses vonden plaats na een mediane follow-up van 24,4 maanden (range: 6,2-44,9 maanden). De resultaten van de eerste interim-analyse vormen de basis voor dit rapport.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van de behandeling
Tussen juli 2016 en augustus 2019 werden 794 patiënten geïncludeerd door 170 centra in 29 landen, gelijkelijk verdeeld over 3 regio’s: Verenigde Staten en Canada, Europa, en Azië en rest van de wereld. In de nivolumab-groep participeerden 532 patiënten en in de placebogroep 262 patiënten. De uitgangskarakteristieken in beide behandelgroepen waren vergelijkbaar: de mediane leeftijd was 61 jaar, 84 procent was man, 81 procent was Kaukasisch, 58 procent had een ECOG-performancestatus van 0, twee derde had stadium III-ziekte, 60 procent had een tumorlokalisatie in de oesofagus, bij ruim twee derde betrof het een adenocarcinoom, de PD-L1-expressie was lager dan 1 procent bij ruim 70 procent, 57 procent had een ≥ ypN1 en 53 procent ypT3 of ypT4. Neoadjuvante chemoradiatie werd aan 99 procent (789 van de 794 patiënten) gegeven. De mediane dosis radiotherapie was 45,0 Gy. Bij het merendeel van de patiënten bestond de chemotherapie uit carboplatine-paclitaxel (73 procent in de nivolumab-groep, 68 procent in de placebogroep); bij de resterende patiënten bestond de chemotherapie uit cisplatine-5-FU (13 procent), 5-FU-oxaliplatine (3 procent) of een ander schema (9-15 procent).
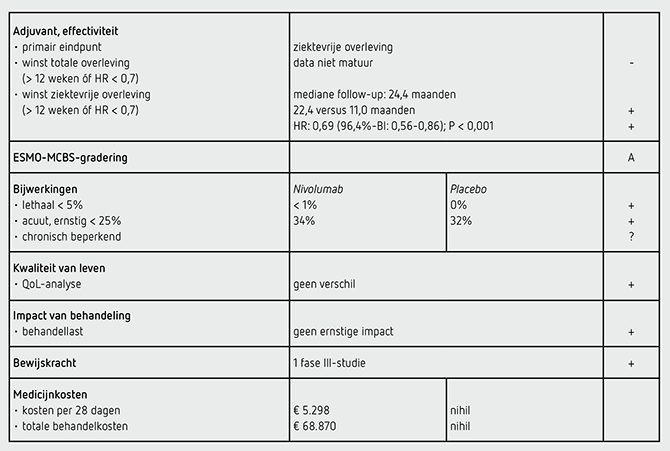
Het primaire eindpunt DFS in de intention to treat-populatie was statistisch significant beter in de nivolumabgroep dan in de placebogroep (HR: 0,69 [96,4%-BI: 0,56-0,86]; P <0,001). De mediane DFS bedroeg 22,4 maanden (95%-BI: 16,6-34,0) in de nivolumab-groep en 11,0 maanden (95%-BI: 8,3-14,3) in de placebogroep. De gegevens over de OS zijn nog niet matuur. Er waren 396 patiënten met een event, waarvan 366 recidiefziekte en 30 overlijdens ten tijde van de interim-analyse.
De DFS was beter bij patiënten behandeld met nivolumab dan met placebo ongeacht het histologisch subtype. Bij adenocarcinoom was de DFS 19,4 versus 11,1 maanden (HR: 0,75 [95%-BI: 0,59-0,96]) en bij plaveiselcelcarcinoom 29,7 versus 11,0 maanden (HR: 0,61 [95%-BI: 0,42-0,88]). Een posthocanalyse van patiënten die 10 weken of langer na resectie werden gerandomiseerd (538 patiënten) toonde een DFS van 21,4 maanden voor de nivolumab-groep versus 10,8
maanden voor de placebogroep (HR: 0,66 [95%-BI: 0,52-0,84]), terwijl bij de 256 patiënten die binnen 10 weken na resectie werden gerandomiseerd er geen statistisch significant verschil tussen beide behandelgroepen was (DFS: 24,0 versus 14,1 maanden [HR: 0,84; 95%-BI: 0,57-1,12]).
De HR voor de DFS was onafhankelijk van de PD-L1- expressie in de tumor. In totaal 129 patiënten hadden een PD-L1 hoger dan 1 procent, met een DFS van 19,7 versus 14,1 maanden (HR: 0,75 [95%-BI: 0,45-1,24] en 570 patiënten hadden een PD-L1 lager dan 1 procent met een DFS van 21,3 versus 11,3 maanden (HR: 0,73 [95%-BI: 0,57-0,92]). Alle 532 patiënten in de nivolumab-groep ontvingen ten minste één gift nivolumab; hiervan kregen 459 patiënten (86 procent) meer dan 90 procent van de doses. In totaal 226 patiënten (42 procent) kregen minimaal éénmaal uitstel van de behandeling. De behandeling met nivolumab werd voortijdig gestaakt bij 48 patiënten (9 procent) vanwege bijwerkingen (meestal diarree, vermoeidheid, jeuk en huiduitslag). In totaal 306 patiënten (58 procent) van de gerandomiseerde 532 patiënten maakten de volledige behandeling van 1 jaar af (8 2-wekelijkse cycli en 9 4-wekelijkse cycli). In de nivolumab-groep hadden 183 patiënten (34 procent) ten minste één bijwerking van graad 3 of 4 en in de placebogroep 84 patiënten (32 procent). In de nivolumab-groep overleed 1 patiënt door bijwerkingen (aan een hartstilstand). De meest voorkomende en de potentieel immuuntherapie-gerelateerde bijwerkingen van alle graderingen in de nivolumab-groep waren vermoeidheid (17 procent), diarree (17 procent), jeuk (10 procent), huiduitslag (10 procent), endocriene toxiciteit (17 procent, waarvan 9 procent hypothyreoïdie en 7 procent hyperthyreoïdie), levertoxiciteit (9 procent, waarvan 5 procent ASAT-stijging), misselijkheid (9 procent), artralgie (6 procent), asthenie (5 procent), verminderde eetlust (5 procent) en nierschade (1 procent).
In de nivolumab-groep kregen 157 patiënten (30 procent) behandeling na progressie. Hiervan kregen slechts 125 patiënten (23 procent) systemische therapie. In de placebogroep kregen 111 patiënten (42 procent) behandeling na progressie. Deze behandeling bestond uit systemische therapie bij 89 patiënten (34 procent), waarvan 19 patiënten (7 procent) immuuntherapie kregen.
Analyses van kwaliteit van leven tonen voor de nivolumabgroep ten opzichte van de placebogroep geen statistisch significant of klinisch relevant andere score voor de FACT-E en de EQ-5D visual analogue scale. Wel is er in beide groepen in de loop van de tijd een klinisch relevante verbetering zichtbaar op de EQ-5D visual analogue scale, waarschijnlijk door functioneel herstel na de slokdarmresectie.
Discussie
In de CheckMate 577-studie wordt een statistisch significant voordeel aangetoond voor het primaire eindpunt DFS na adjuvante behandeling met nivolumab ten opzichte van placebo bij patiënten met een oesofaguscarcinoom of een carcinoom van de gastro-oesofageale overgang bij wie er sprake was van een radicale resectie en aantoonbare residuele tumor (HR: 0,69 [96,4%-BI: 0,56-0,86]; P <
0,001). De resultaten van dit eindpunt voldoen aan de PASKWIL-criteria voor adjuvante studies voor een – voorlopig – positief advies. Na rapportage van de OS-data zal een definitief advies volgen.
Deze studie heeft wereldwijd in 170 centra gelopen; ruim twee derde van de patiënten onderging het ook in Nederland gebruikelijke CROSS-schema van chemoradiatie met carboplatine en paclitaxel. Dit maakt de resultaten goed toepasbaar voor de dagelijkse praktijk in Nederland.
Het is opvallend dat er voor deze adjuvante studie niet is gekozen voor overleving als primair eindpunt in een populatie met een hoog risico op een recidief binnen 2 jaar en een slechte prognose (ongeveer 30 procent van de patiënten overlijdt binnen 2 jaar).1 Het is de vraag of DFS bij oesofaguscarcinoom een acceptabel surrogaateindpunt is voor OS. Als bewijs dat OS en DFS goed correleren, presenteren de onderzoekers alleen een meta-analyse met trials van patiënten met maagcarcinoom, behandeld met chemotherapie in studies zonder overlevingsvoordeel.4 De mediane DFS in de placebogroep in deze studie is slechts 11 maanden, hetgeen korter is dan de 19,2 maanden geobserveerd in de dagelijkse praktijk in een vergelijkbare populatie in Nederland.5
Opvallend in deze studie is dat er geen omschrijving is in het protocol noch in de studieresultaten van de tijd van PA-diagnose tot start van de behandeling met chemoradiatie (streven is in Nederland 6 weken), noch van het interval tussen het beëindigen van de chemoradiatie en slokdarmresectie (gebruikelijk is in Nederland rond 8 tot 10 weken). Alleen de tijd tussen chirurgie en start van de studiebehandeling is goed omschreven (4 tot 16 weken), waarbij opvallend is dat 68
procent van de patiënten ten minste 10 weken na resectie start met de studiebehandeling. Dit kan invloed hebben op de in deze studie geobserveerde tijd tot ziekteprogressie.
De systemische behandeling na progressieve ziekte is beperkt, zowel in de nivolumab-groep als in de placebogroep; zeker gezien de geselecteerde patiëntenpopulatie met een goede performancestatus en frequente evaluaties. Daarnaast lijkt het behandeleffect van nivolumab beperkt in de grootste groep patiënten van de studie: de patiënten met een adenocarcinoom (en vaak tumoren van de gastrooesofageale overgang). Er is geen formeel eindpunt voor alleen de patiënten met een plaveiselcelcarcinoom en deze subgroep is ook niet separaat door de EMA geregistreerd. Er is in deze studie geen relatie aangetoond tussen PD-L1- expressie en behandeleffect.
5. Kosten
De behandeling met nivolumab 480 mg kost 5.298 euro per behandelcyclus van 28 dagen (bron: www.medicijnkosten.nl d.d. 26 augustus 2021). De totale medicatiekosten van 1 jaar behandeling komen daarmee op 68.870 euro. De werkelijk betaalde prijs is niet bekend omdat nivolumab nog tot in ieder geval begin 2024 in de sluis zit.
Conclusie
In de hier besproken CheckMate 577-studie wordt bij patiënten met een oesofaguscarcinoom of carcinoom van de gastro-oesofageale overgang, na chemoradiatie en radicale resectie voor residuale ziekte, na een follow-up van mediaan 24,4 maanden een statistisch significant langere DFS gezien na adjuvante behandeling met nivolumab dan na placebo (HR: 0,69 [96,4%-BI: 0,56-0,86]; P <0,001). Er zijn nog geen mature OS-data gepubliceerd. Dit resultaat voldoet aan de criteria voor een – voorlopig – positief advies volgens de PASKWIL-criteria voor adjuvante behandeling.