In november 2011 heeft de NVMO-commissie BOM haar criteria voor de beoordeling van de effectiviteit van nieuwe behandelingen – de PASKWIL-criteria – gereviseerd. Na de acceptatie van deze nieuwe beoordelingscriteria heeft het NVMO-bestuur, hiertoe gemandateerd door de algemene ledenvergadering van de NVMO van november 2011, aan de commissie verzocht een aantal eerder gepubliceerde beoordelingen opnieuw onder de loep te nemen.
In dit kader wordt hier de plaats van bevacizumab in de (gangbare) eerstelijns behandeling van het gemetastaseerd colorectaalcarcinoom (CRC) opnieuw besproken. Daarbij worden de eerder beoordeelde studies afgezet tegen de huidige PASKWIL-criteria. Bij de beoordeling is tevens een in 2009 verrichte meta-analyse van de Cochrane Collaboration naar anti-angiogene therapie voor gemetastaseerd CRC meegenomen [1]. Tot slot is een studie uit 2010, die de toevoeging van bevacizumab aan capecitabinemonotherapie heeft bestudeerd, meegenomen in de totale beoordeling [2].
Introductie
Bevacizumab is een monoklonaal antilichaam dat bindt aan VEGF voordat dit zich aan de VEGF-receptor kan binden. Bevacizumab remt de tumorgerelateerde angiogenese of bloedvatnieuwvorming.
In 2005 concludeerde de NVMO-commissie BOM dat de toevoeging van bevacizumab aan fluoropyrimidine-bevattende chemotherapie bij de eerstelijns behandeling van het gemetastaseerd CRC meerwaarde had [3]. Deze conclusie was gebaseerd op een analyse van studies waarbij bevacizumab werd toegevoegd aan een wekelijks schema van 5-fluorouracil /leukovorine en aan een wekelijks schema van irinotecan gecombineerd met 5-fluorouracil /leukovorine [4, 5]. In 2008 beoordeelde de commissie BOM de plaats van bevacizumab in combinatie met oxaliplatine-bevattende schema’s in de eerstelijns behandeling van het gemetastaseerd CRC [6] naar aanleiding van een studie waarbij bevacizumab werd toegevoegd aan de combinatie van fluoropyrimidine met oxaliplatine [7]. Deze combinatie werd en wordt in Nederland beschouwd als standaard voor de eerstelijns behandeling van het gemetastaseerd CRC. De conclusie luidde als volgt: ‘Met inachtneming van eerdere studieresultaten heeft toevoeging van bevacizumab aan standaardchemotherapie beperkte meerwaarde, mits de behandeling langere tijd – dat wil zeggen: tot progressie – kan worden gecontinueerd’ [6].
1. Kankersoort en lijn van behandeling
De betekenis van bevacizumab toegevoegd aan chemotherapie bij de eerstelijns behandeling van het gemetastaseerd CRC wordt besproken. Voor zover bekend is in één studie gekeken naar de toegevoegde waarde van bevacizumab in tweedelijns behandeling van het gemetastaseerd CRC, maar deze studie zal hier buiten beschouwing worden gelaten.
2. Vergelijking met de referentiebehandeling in Nederland
In Nederland is oxaliplatine- en 5-fluorouracil-bevattende chemotherapie, meestal de combinatie van capecitabine met oxaliplatine, de standaard voor de eerstelijns behandeling van het gemetastaseerd CRC. Studies die eerder werden besproken betroffen de eerstelijns behandeling van het gemetastaseerd CRC met bevacizumab toegevoegd aan 5-fluorouracilmonotherapie gegeven in een wekelijks schema [4] en toegevoegd aan bolus 5-fluorouracil in combinatie met irinotecan gegeven in een wekelijks schema [5]. Deze beide regiems worden in Nederland nauwelijks (meer) toegepast.
In recenter studies is bevacizumab toegevoegd aan oxaliplatine- en 5-fluorouracil-bevattende chemotherapie [7] en capecitabine-monotherapie [2]. Deze beide regiems worden in Nederland geregeld toegepast. Behandeling met capecitabine- monotherapie wordt toegepast wanneer een patiënt niet fit genoeg is voor combinatietherapie of wanneer er andere redenen zijn om geen oxaliplatine-bevattende therapie in de eerstelijns behandeling voor te schrijven.
3. Methode en kwaliteit van de studies
De internationale Saltz-studie [7] begon als een gerandomiseerde studie om XELOX met FOLFOX te vergelijken, maar werd na het verschijnen van de resultaten van de Hurwitz-studie veranderd in een 2 x 2 factorial design door het introduceren van een tweede randomisatie tussen bevacizumab en placebo. Inclusiefactoren waren: leeftijd 18 jaar en ouder, één of meer meetbare laesies niet in aanmerking komend voor curatieve resectie, performancescore lager of gelijk aan 1 en een levensverwachting van méér dan 3 maanden. Stratificatiefactoren waren regio van behandeling, performancescore, lever als locatie van metastase, alkalische fosfataseniveau en aantal gemetastaseerde lokalisaties. De behandeling zou volgens protocol worden doorgezet tot aan progressie of gedurende 48 weken. Patiënten waarbij de tumor kon worden geopereerd konden ook worden doorbehandeld met de studiemedicatie (tot PD).
De analyse van de gegevens verliep in stappen: de eerste stap betrof een analyse van gepoolde XELOX- versus gepoolde FOLFOX-4-bevattende groepen volgens het intention-to-treat-principe. Als het resultaat aangaande de toevoeging van bevacizumab aan deze regiems positief zou zijn, dan zou een test voor interactie tussen de verschillende componenten (FOLFOX-4, XELOX, bevacizumab en niet-bevacizumab) met betrekking tot progressievrije overleving (PFS) worden uitgevoerd. Alleen wanneer de test voor interactie negatief zou zijn, dan zou de eerste analyse als de primaire analyse worden beschouwd.
Patiënten die een curatieve metastatectomie ondergingen werden ‘gecensored’ op het moment van operatie. De eindanalyse voor een non-inferiority-analyse zou plaatsvinden bij 1.200 events en de studie zou dan 90 procent power hebben bij een eenzijdige α van 2,5 procent. Tegelijkertijd werden 985 events verwacht voor de vergelijking van bevacizumab versus controle. Deze gepoolde superioriteitsvergelijking zou 98 procent power hebben om een hazard ratio van 0,75 vast te stellen.
De studie van Tebbutt [2] betrof een drie-armige studie: capecitabine, capecitabine plus bevacizumab (CB) en capecitabine plus bevacizumab plus mitomycine (CBM). De primaire analyse vergeleek de PFS van capecitabine met CB en van capecitabine met CBM. De inclusiecriteria van deze studie waren iets ruimer in die zin dat ook niet-meetbare ziekte en ECOG-performancestatus 2 mocht worden geïncludeerd. Stratificatiefactoren waren leeftijd (< 65 jaar, ≥ 65 jaar), performancescore en capecitabinedosis (1 of 1,25 g/m2). Behandeling zou moeten worden gecontinueerd tot aan progressie. Om met 80 procent power een hazard ratio van 0,67 te detecteren (een verbetering in mediane PFS van 2,5 maanden) met een nominale P-waarde van 5 procent voor beide vragen samen (ieder 2,5 procent afzonderlijk), waren in totaal 450 patiënten nodig (150 per arm). Het primaire eindpunt was progressievrije overleving en secundaire eindpunten waren totale overleving, toxiciteit, responskans en kwaliteit van leven. Omdat in Nederland mitomycine niet wordt voorgeschreven voor eerstelijns behandeling van gemetastaseerd CRC, is in de analyse van de NVMO-commissie BOM deze behandel-arm uit de studie niet meegenomen.
In de Cochrane-meta-analyse zijn 4 studies met in totaal 2.526 patiënten opgenomen, waarbij bevacizumab als eerstelijns behandeling bij gemetastaseerd CRC wordt geëvalueerd. Aangezien de producent van bevacizumab geen toegang gaf tot de individuele patiëntengegevens van de afzonderlijke studies, is deze meta-analyse gebaseerd op geaggregeerde informatie. De resultaten van de Tebbutt-studie [2] zijn niet opgenomen in deze meta-analyse omdat de resultaten van deze studie toen nog niet waren gepubliceerd.
4. Effectiviteit van de behandeling afgezet tegen de bijwerkingen en impact van behandeling
Saltz-studie [7]
In totaal omvatte de bevacizumab-bevattende groepen 699 patiënten en de placebohoudende groepen 701 patiënten. Zij waren geïncludeerd tussen februari 2004 en februari 2005. De patiëntengroepen waren onderling goed vergelijkbaar ten aanzien van leeftijd (mediaan 60 jaar), performancestatus (60 procent; PS: 0), primaire tumor (67 procent colon en 33 procent rectum), synchrone metastasen (35-40 procent), aantal aangedane organen (38-44 procent één orgaan; 32-36 procent twee organen) en voorafgaande adjuvante chemotherapie (22-26 procent). Zowel klinisch als statistisch significante behandelingsinteractie kon worden uitgesloten (P = 0,7), waardoor geplande gepoolde analyse kon worden uitgevoerd. De PFS was significant toegenomen met bevacizumab vergeleken met placebo wanneer gecombineerd met oxaliplatine- bevattende chemotherapie (9,4 versus 8,0 maanden; HR: 0,83; 97,5% CI: 0,72-0,95; P < 0,0023). De mediane duur van behandeling was in beide groepen vergelijkbaar (bevacizumab 190 dagen en placebo 176 dagen). Weinig patiënten werden behandeld tot na 48 weken (respectievelijk 9 en 6 procent). In de bevacizumab-groep werd therapie door 29 procent van de patiënten gestopt als gevolg van progressie. In de placebo-groep was dit percentage 47 procent. In een vooraf bepaalde secundaire analyse werd gekeken naar de zogenaamde on-treatment PFS. Hierbij werden alleen progressie of sterfte binnen 28 dagen na de laatste behandeling als event meegenomen. Deze analyse toonde een tijd tot progressie van mediaan 10,4 en 7,9 maanden met en zonder bevacizumab (HR: 0,63; 97,5% CI: 0,52-0,75; P < 0,0001). In een geplande subgroepanalyse tussen FOLFOX en XELOX met en zonder bevacizumab bleek dat het effect van bevacizumab wel werd gezien met XELOX als backbone (HR: 0,77; P = 0,0026), maar niet bij FOLFOX (HR: 0,89; P = 0,187). Voor de studie als geheel bleek dat de toevoeging van bevacizumab aan oxaliplatine-bevattende chemotherapie geen significant effect had op de totale overleving (HR: 0,89; 97,5% CI: 0,76-1,03), terwijl slechts 5 procent van de patiënten in de placebo-groep en 3 procent in de bevacizumab- groep de bevacizumab-behandeling continueerden. De overleving bedroeg mediaan 21,3 maanden voor de bevacizumab-bevattende chemotherapie en 19,3 maanden voor de placebo-groepen. Ook de responspercentages waren vergelijkbaar in beide groepen.
Toxiciteit, grotendeels toegeschreven aan de gegeven chemotherapie, was in de bevacizumab-groepen bij 30 procent en in de placebo-groepen bij 21 procent reden om de behandeling te stoppen (vóór progressie). Stoppen vanwege toxiciteit graad III-IV gebeurde bij respectievelijk 21 en 15 procent. Het betrof voornamelijk neurotoxiciteit, gastro-intestinale gebeurtenissen en hematologische problemen. Bij respectievelijk 5 en 2 procent van de patiënten leek de toxiciteit het gevolg te zijn van bevacizumab of placebo.
Tebbutt-studie [2]
In totaal werden 471 patiënten door 36 instituten uit Australië, 2 uit Nieuw-Zeeland en 3 uit Groot-Brittannië geïncludeerd tussen juli 2005 en juni 2007. Patiëntkarakteristieken laten zien dat het om een groep patiënten gaat met relatief gunstige prognostische kenmerken. De patiëntengroepen waren onderling goed vergelijkbaar ten aanzien van leeftijd (C en CB mediaan respectievelijk 69 en 67 jaar), performancestatus (C en CB respectievelijk 96 en 92 procent; PS: 0-1), primaire tumor (C en CB respectievelijk 68 en 62 procent colon; 26 en 18 procent rectum), plaats en uitbreiding van het aantal aangedane organen en voorafgaande adjuvante chemotherapie (C en CB respectievelijk 22 en 28 procent). De mediane follow-up voor beide studiegroepen was 30,8 maanden. De mediane behandelduur in de CB-arm was 10 cycli (1-59) en in de C-arm was deze 8 cycli (1-36). De mediane dosisintensiteit voor capecitabine was 92 procent in de CB-arm en 100 procent in de C-arm. De mediane progressievrije overleving bedroeg 8,5 maanden in de CB-arm en 5,7 maanden in de C-arm, hetgeen een 37 procent afname betekent in het relatieve risico op progressie van ziekte (HR: 0,63; 95% CI: 0,50-0,79; P < 0,001). De mediane totale overleving bedroeg 18,9 maanden in zowel de C- als CB-arm (HR: 0,875; 95% CI: 0,68-1,13; P = 0,314). De responspercentages volgens RECIST waren vergelijkbaar in beide armen. In de CB-arm kwamen significant (P = 0,03) meer hand-voetsyndroom en arteriële trombotische gebeurtenissen (P < 0,03) voor. Overige toxiciteit graad III-IV kwam in beide armen evenveel voor. Analyse van de kwaliteit van leven toonde meer pijnklachten aan handen en voeten en in de mond in de CB-arm. De tweedelijns behandeling verschilde niet tussen beide groepen (68 procent in de C-arm en 62 procent in de CB-arm werd na staken van de studiemedicatie behandeld met vervolgbehandeling(en)).
Cochrane-analyse [1]
In de Cochrane-meta-analyse zijn 4 studies met in totaal 2.526 patiënten opgenomen waarbij bevacizumab als eerstelijns behandeling bij gemetastaseerd CRC wordt geëvalueerd, waaronder de Salz-studie [7]. De resultaten van de Tebbutt-studie [2] waren toen nog niet gepubliceerd. De conclusie van de meta-analyse luidde dat bevacizumab als eerstelijns behandeling bij gemetastaseerd CRC de PFS verbeterde met een overall HR van 0,61 (95% CI: 0,45-0,83). Voor de studies gezamenlijk komt dit overeen met een mediane toename in PFS van 7,1 naar 9,6 maanden. Tegelijkertijd werd echter ook geconstateerd dat het effect op de PFS significante heterogeniteit vertoonde (P = 0,0004). Van de beoordeelde studies in deze analyse werd vooral die van Hurwitz [5] bekritiseerd vanwege de verandering in frequentie van metingen van iedere 6 naar iedere 12 weken na 6 maanden, de ‘inferieure’ chemotherapie (irinotecan plus bolus 5-fluorouracil) en het feit dat de respons niet door een onafhankelijke radioloog werd gemeten. De overige studies waren in grote mate vergelijkbaar wat uitvoering betreft. In termen van HR voor PFS was het juist de Saltz-studie [7] die afweek van de rest met een HR van 0,83 tegenover een HR van 0,54 bij 2 studies op basis van bolus 5-fluorouracil alleen en een HR van 0,50 bij een studie op basis van irinotecan en bolus 5-fluorouracil. Als mogelijke reden van deze heterogeniteit wordt de duur van behandeling aangegeven: in de Saltz-studie [7] werd van alle patiënten slechts 29 procent (bevacizumab-arm) en 47 procent (placebo-arm) behandeld tot aan progressie. Daardoor was de mediane duur van behandeling met bevacizumab met 6 maanden in deze studie ook korter dan de mediane duur bij de overige studies (Hurwitz: 10 maanden). De resultaten van de studie van Tebbutt lijken zich met een HR van 0,63 dichter in de buurt te bevinden van de overall HR. Overlevingswinst werd in de Hurwitzstudie gezien, maar kon niet worden bevestigd in de overige studies, inclusief die van Tebbutt [2]. Bias als gevolg van cross-over speelt hierbij waarschijnlijk geen grote rol.
|
Kabbinavar [4] |
Hurwitz [5] |
|||
|
Pallatief, effectiviteit |
||||
|
9,2 vs 5,5 maanden |
|
10,6 vs 6,2 maanden |
|
|
16,6 vs 12,9 maanden |
|
20,3 vs 15,6 maanden |
+ + |
|
|
||||
|
Bijwerkingen |
||||
|
|
|
|
+ |
|
|
|
|
- |
|
|
|
|
? |
|
|
||||
|
Kwaliteit van leven |
||||
|
|
|
|
? |
|
|
||||
|
Impact van behandeling |
||||
|
+ |
|
|
+ |
|
|
||||
|
Level of evidence |
|
|
|
+ |
Tabel 1. Resultaten besproken studies afgezet tegenover de PASKWIL-criteria anno 2012.
|
Saltz [7] |
Tebbutt [2] |
|||
|
Pallatief, effectiviteit |
||||
|
9,4 vs 8,0 maanden |
|
|
|
|
21,3 vs 19,9 maanden |
|
18,9 vs 18,9 maanden |
- - |
|
|
||||
|
Bijwerkingen |
||||
|
|
|
|
+ |
|
|
|
|
+ |
|
|
|
|
? |
|
|
||||
|
Kwaliteit van leven |
||||
|
|
|
|
+ |
|
|
||||
|
Impact van behandeling |
||||
|
+ |
|
|
+ |
|
|
||||
|
Level of evidence |
|
|
|
+ |
Tabel 2. Resultaten besproken studies afgezet tegenover de PASKWIL-criteria anno 2012.
Samenvattend
In 2005 oordeelde de NVMO-commissie BOM aan de hand van de toen geldende criteria dat ‘toevoeging van bevacizumab aan een 5-fluorouracil-/leukovorine-bevattend chemotherapieschema (5-fluorouracil alleen of 5-fluorouracil in combinatie met irinotecan) als eerstelijns behandeling van patiënten met een gemetastaseerd colorectaalcarcinoom meerwaarde heeft’. Echter: deze schema’s zijn anno 2012 géén standaardtherapie meer.
In 2008 oordeelde de NVMO-commissie BOM op grond van resultaten van een fase III-studie [7] dat ‘toevoeging van bevacizumab aan oxaliplatine-bevattende chemotherapie bij de eerstelijns behandeling van patiënten met een gemetastaseerd colorectaalcarcinoom leidt tot een beperkte verlenging van de progressievrije overleving, zonder toename van responskans of overleving, mits voortgezet tot progressie’.
Wanneer de resultaten van de Saltz-studie [7] worden afgezet tegen de nieuwe PASKWIL-criteria, voldoen de resultaten niet aan de te stellen eisen van effectiviteit. Relevante winst in progressievrije overleving werd uitsluitend gezien in de subgroep van patiënten die werden behandeld tot progressie en bij patiënten die werden behandeld met capecitabine-oxaliplatine. De resultaten van de Tebbutt-studie [2] voldoen volgens de PASKWIL-criteria 2012 aan de te stellen eisen van effectiviteit met een significante winst in progressievrije overleving. Gezamenlijk laten de 4 studies beoordeeld in de Cochraneanalyse [1] een beeld zien dat toevoeging van bevacizumab aan eerstelijns chemotherapie van het gemetastaseerd CRC, zij het niet consistent, leidt tot een toename van de progressievrije overleving met een HR minder dan 0,7 en een absolute duur van meer dan 2 maanden.
Toevoeging van bevacizumab aan de in Nederland gangbare eerstelijns behandeling van patiënten met een gemetastaseerd CRC leidt volgens géén van de beoordeelde studies tot winst in totale overleving.
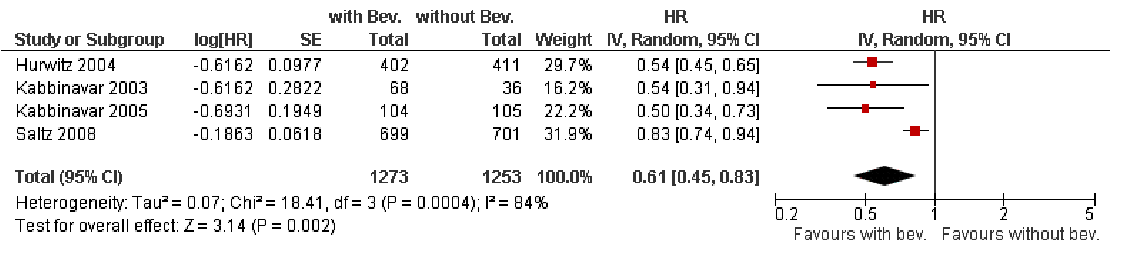
Figuur 1. Effect van toevoeging bevacizumab aan eerstelijns chemotherapie bij gemetastaseerd colorectaalcarcinoom [1].
5. Kosten
Bevacizumab wordt gegeven in een dosering van 7,5 mg/kg elke 3 weken. Bij een gewicht van 75 kg en een prijs van 317 euro per ampul van 100 mg bedragen de behandelkosten per maand gemiddeld 2.400 euro
Conclusie
Toevoeging van bevacizumab aan fluorpyrimidine-monotherapie of fluorpyrimidine- en oxaliplatine-combinatietherapie bij de eerstelijns behandeling van patiënten met een gemetastaseerd CRC leidt tot significante winst in progressievrije overleving van méér dan 2 maanden met een HR lager dan 0,7 indien de behandeling met bevacizumab wordt doorgezet tot aan progressie en voldoet hiermee aan de te stellen eisen van effectiviteit zoals vastgelegd in de nieuwe PASKWILcriteria anno 2012. De mate van effect is afhankelijk van het chemotherapieregiem. Toevoeging van bevacizumab aan chemotherapie leidt tot een herkenbaar profiel van toxiciteit, voornamelijk bestaande uit proteïnurie, hypertensie en arteriële trombo-embolische gebeurtenissen.