In 2005 heeft de commissie BOM geconcludeerd dat toevoeging van bevacizumab aan fluoropyrimidinebevattende chemotherapie bij eerstelijnsbehandeling van patiënten met een gemetastaseerd colorectaalcarcinoom meerwaarde had [1]. Deze conclusie was gebaseerd op twee studies waarin bevacizumab werd toegevoegd aan een wekelijks schema van irinotecan gecombineerd met 5-FU/leucovorin (Hurwitz et al [2]) of aan een wekelijks schema van 5-FU/leucovorin (Kabbinavar et al [3]). In beide studies nam het responspercentage toe met ongeveer 10 procent, de progressievrije overleving (PFS) met respectievelijk 4,4 maanden en 3,7 maanden en de totale overleving met respectievelijk 4,7 maanden en 3,7 maanden. Omdat de extra toxiciteit door toevoeging van bevacizumab beperkt was, werd volgens de Paskwil-criteria gesteld dat toevoeging van bevacizumab aan 5FU-bevattende chemotherapie voortaan als standaardbehandeling kon worden beschouwd.
Recentelijk verschenen de resultaten van een grote studie van Saltz et al [4], waarin de meerwaarde van toevoeging van bevacizumab aan de combinatie van fluoropyrimidine (FOLFOX-4 of capecitabine) met oxaliplatine als eerstelijnsbehandeling van patiënten met gemetastaseerd colorectaalcarcinoom werd onderzocht.
De resultaten van deze studie hebben geleid tot een hernieuwd advies van de commissie BOM over bevacizumab voor deze indicatie.
Opzet studie
In deze studie van Saltz et al werden 1.041 patiënten in een 2 x 2 factorial design gerandomiseerd tussen behandeling met FOLFOX-4 of XELOX met bevacizumab of placebo. De behandelschema’s zijn weergegeven in figuur 1. Binnen de opzet van de studie werd de behandeling gecontinueerd tot progressie of voortgezet tot 48 weken. Primair eindpunt van de studie was PFS.
Secundaire eindpunten waren totale overleving, responspercentage, responsduur en tijd tot progressie. De resultaten van de studie zijn samengevat in tabel 1.
Wat opvalt is dat er slechts een geringe toename was in PFS (9,4 maanden versus 8,0 maanden; p = 0,0023) en dat er geen verschillen waren met betrekking tot de overige eindpunten van de studie.
In een geplande subsetanalyse werd gekeken of er verschil was tussen toevoeging van bevacizumab aan FOLFOX of aan XELOX.
Hieruit bleek dat alleen in combinatie met XELOX een klinisch significante, maar bescheiden verlenging van de PFS werd bereikt (9,3 maanden versus 7,4 maanden; HR: 0,77; CI: 0,63-0,94). De overige eindpunten waren niet verschillend. De tweedelijnsbehandeling verschilde niet tussen beide groepen (respectievelijk 46 procent en 53 procent werd na staken van de studiemedicatie behandeld met irinotecan met of zonder bevacizumab, 5-FU, capecitabine, cetuximab of bevacizumabmonotherapie). De patiëntgroepen waren onderling goed vergelijkbaar ten aanzien van leeftijd (mediaan 60 jaar), performancestatus (60 procent; PS = 0), primaire tumor (67 procent colon en 33 procent rectum), synchrone metastasen (35-40 procent), het aantal aangedane organen (38-44 procent: 1 orgaan; 32-36 procent: 2 organen; overige: 3 organen of meer) en voorafgaande adjuvante chemotherapie (22-26 procent).
De auteurs opperen dat het verschil in PFS kleiner was dan verwacht, doordat de patiënten in beide groepen relatief kort werden behandeld (27 weken versus 25 weken). In de bevacizumabgroep werd slechts 29 procent van de patiënten behandeld tot progressie en in de placebogroep 47 procent. Toxiciteit, grotendeels toegeschreven aan de gegeven chemotherapie, vormde bij respectievelijk 30 procent en 21 procent de reden om de behandeling te stoppen. Bij respectievelijk 5 procent en 2 procent van de patiënten leek de toxiciteit het gevolg te zijn van bevacizumab of placebo. Bovendien bleek bij tweederde van de patiënten bij wie toxiciteit de oorzaak van het stoppen van de behandeling was, sprake te zijn van toxiciteit graad 1-2. Hierdoor werd slechts bij een kleine groep patiënten bevacizumab als monotherapie gecontinueerd.
Dit is een duidelijk verschil met de studies van Hurwitz et al [2] en Kabbinavar et al [3], waarin de behandeling in de bevacizumabarm 7 tot 13 weken langer werd gecontinueerd. De auteurs onderbouwen hun veronderstelling dat langer behandelen een groter verschil in PFS zou hebben laten zien, door introductie van een secundair eindpunt: PFS on treatment (ziet tabel 1). Hierin wordt de mediane tijd tot progressie gecorrigeerd (‘gecensored’) voor events die optreden 4 weken of langer na het staken van de behandeling.Op deze manier gedefinieerd bedroeg de PFS on treatment 10,4 maanden voor de groep met bevacizumab en 7,9 maanden voor de placebogroep (p < 0,0001).
Overigens is hiermee het ontbreken van een verschil in respons niet verklaard. De toename van toxiciteit (graad 3-4) door toevoeging van bevacizumab bedroeg 16 procent en door toevoeging van placebo trad bij 8 procent toxiciteit graad 3-4 op. Veneuze trombo-embolische complicaties (8 procent versus 5 procent) en hypertensie (4 procent versus 1 procent) kwamen vaker voor tijdens behandeling met bevacizumab.
Gastro-intestinale perforaties, gestoorde wondgenezing en proteïnurie kwamen nauwelijks of niet voor.
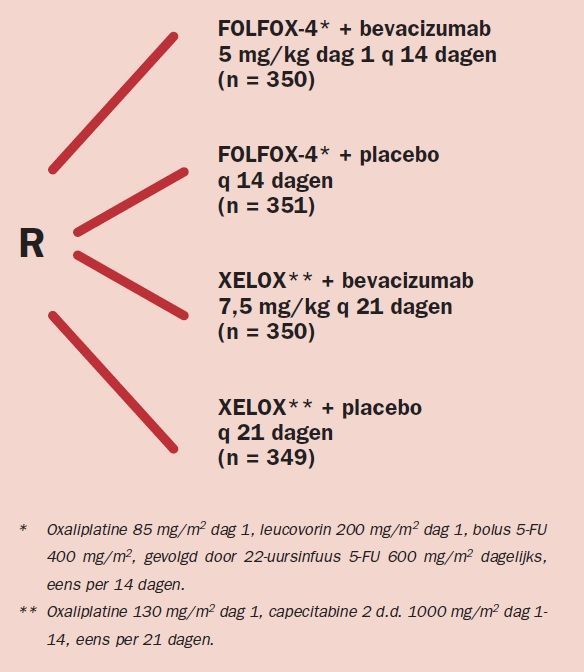
Figuur 1. Bevacizumab versus placebo in combinatie met oxaliplatinebevattende chemotherapie bij gemetastaseerd colorectaalcarcinoom.
Beschouwing
Toevoeging van bevacizumab aan oxaliplatinebevattende chemotherapie leidde in deze studie tot een geringe toename van de PFS, zonder effect op de OS, RR of responsduur. De toename in PFS is duidelijk kleiner dan bij eerdere combinatie met irinotecanbevattende chemotherapie. De oorzaak van het kleinere verschil wordt door de auteurs toegeschreven aan het voortijdig staken van de bevacizumabtoediening – dat wil zeggen: voordat ziekteprogressie optrad en zonder dat toxiciteit (graad 1-2) hiertoe aanleiding gaf. In de discussie geven de auteurs aan dat ‘some investigators may not have fully appreciated that the protocol specifically permitted the discontinuation of one or more drugs while allowing for the continuation of others’.
Niet alleen in vergelijking met de studies van Hurwitz et al en Kabbinavar et al zijn de resultaten van deze FOLFOX/ XELOX-studie teleurstellend. Ook in vergelijking met eerdere studies waarin bevacizumab aan een oxaliplatinebevattend schema werd toegevoegd, wijken de huidige resultaten af. In 2007 publiceerden Giantonio et al [5] de resultaten van een gerandomiseerde studie waarin FOLFOX-4 als behandeling – in de tweede lijn – werd gecombineerd met bevacizumab of werd vergeleken met bevacizumabmonotherapie. Toevoeging van bevacizumab aan oxaliplatinebevattende chemotherapie (na eerdere progressie onder behandeling met irinotecan en 5-FU) leidde tot een langere overleving (van 10,8 maanden naar 12,9 maanden; p = 0,0011), een toename van de PFS (van 4,7 maanden naar 7,3 maanden; p < 0,0001) en een hoger responspercentage (van 8,6 procent naar 22,7 procent; p < 0,0001).
| Bevacizumab + FOLFOX-4 of XELOX |
Placebo + FOLFOX-4 of XELOX |
Verschil |
P-waarde |
Paskwil- criteria |
|
| PFS |
9,4 mnd (p = 0,0023) |
8,0 mnd |
1,4 mnd |
0,0023 |
+/- |
| PFS on treatment |
10,4 mnd (p < 0,0001) 7,9 |
7,9 mnd |
2,5 mnd |
< 0,0001 |
+ |
| OS | 21,3 mnd (n.s.) | 19,9 mnd | 1,4 mnd | n.s. | - |
| RR | 38%* (47%) | 38%* (49%) | 0% | n.s. | - |
| Responsduur | 8,4 mnd | 7,4 mnd | 1,0 mnd | n.s. | - |
| TTF | 6,9 mnd | 6,0 mnd | 0,9 mnd | n.s. | - |
| * Opgegeven percentages na correctie door Independent Response Review Committee (tussen haakjes: door onderzoekers zelf opgegeven percentages). |
|||||
Tabel 1. Samenvatting van de studieresultaten van Saltz et al [4].
Bespreking
De studie van Saltz et al is een grote studie (N = 1.041) met een heldere opzet bij patiënten die in eerste lijn worden behandeld met een oxaliplatinebevattend schema in verband met een gemetastaseerd colorectaalcarcinoom. De patiëntkarakteristieken laten zien dat het om een groep patiënten gaat met relatief gunstige prognostische kenmerken, vergelijkbaar met de patiënten in de studie van Hurwitz et al. In tegenstelling tot deze studie blijkt bij Saltz et al dat toevoeging van bevacizumab aan een oxaliplatinebevattend schema slechts tot een beperkte verlenging van de PFS leidt, zonder een gunstige effect op overleving of responskans. Op zich beoordeeld zou op grond van de Paskwil-criteria aan bevacizumab, zoals toegepast in de studie van Saltz, geen meerwaarde worden toegekend. Omdat de andere genoemde studies, hoewel deels anders van opzet, wel bij het eerder gepubliceerde oordeel van de commissie BOM aansluiten, zijn er op dit moment onvoldoende argumenten om het oordeel over bevacizumab te herroepen. De commissie is wel van oordeel dat de behandelduur met bevacizumab (tot progressie) van invloed zou kunnen zijn op de bereikte resultaten [6, 7].
Samenvatting
Toevoeging van bevacizumab aan oxaliplatinebevattende chemotherapie bij de eerstelijnsbehandeling van patiënten met een gemetastaseerd colorectaalcarcinoom leidt tot een beperkte verlenging van de progressievrije overleving, zonder toename van responskans of overleving. Deze resultaten zijn teleurstellend in vergelijking tot andere studies.
Uitgaande van de huidige gegevens lijkt toevoeging van bevacizumab aan chemotherapie alleen meerwaarde te hebben als de behandeling kan worden voortgezet tot progressie of onacceptabele toxiciteit.
Toevoeging van bevacizumab om een hogere of snellere respons te bereiken, lijkt in combinatie met XELOX of FOLFOX op grond van deze studie niet zinvol.
Conclusie
Met inachtneming van eerdere studieresultaten heeft toevoeging van bevacizumab aan standaardchemotherapie beperkte meerwaarde, mits de behandeling langere tijd – dat wil zeggen: tot progressie – kan worden gecontinueerd.